液流電池是如何工作的?
液流電池的核心是專門設計的可再生燃料電池模塊。傳統的再生燃料電池基于可逆電解電化學過程運行,可以是開放系統(其中可以添加水,并去除氫和氧)或封閉系統。這些基于電解的再生燃料電池通常僅限于幾千瓦的功率。液流電池在不同的電化學過程中運行,并且比傳統的再生燃料電池更具可擴展性。液流電池的大小可達幾兆瓦。
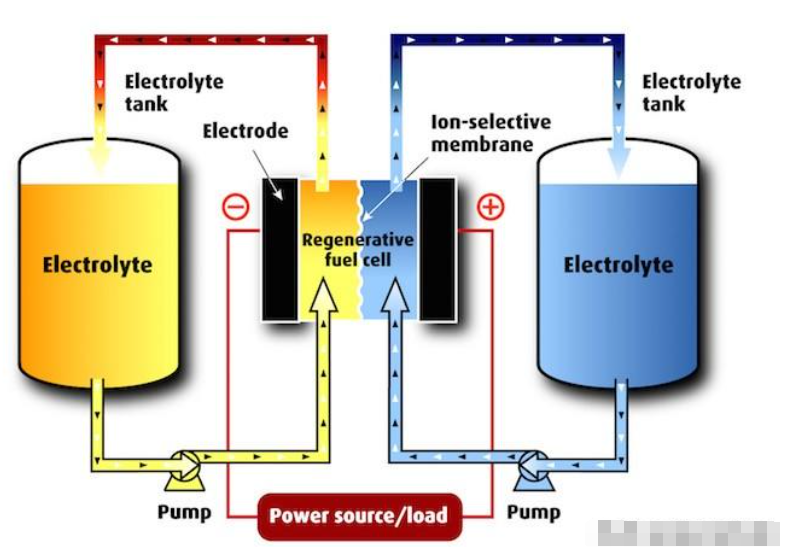
液流電池的基本構造和操作(圖片來源:Electrosynthesis)
液流電池基于各種氧化還原(還原/氧化)化學反應運行,其中電子在不同氧化態的化學物質之間轉移。雖然有幾種可能的化學品可用于制造液流電池,但當今的商用液流電池通常使用氯化鐵、溴化鋅或釩。
氯化鐵液流電池和鋅溴液流電池都可以看作是電鍍機。在充電過程中,鐵或鋅被電鍍到導電電極上。在放電過程中,發生相反的過程:鍍在負極上的金屬鐵或鋅溶解在電解液中,可以在下一個充電周期再次鍍上。這兩種化學物質都可以長時間完全放電而不會損壞。如下所述,釩液流電池在不同的化學基礎上運行。
氯化鐵
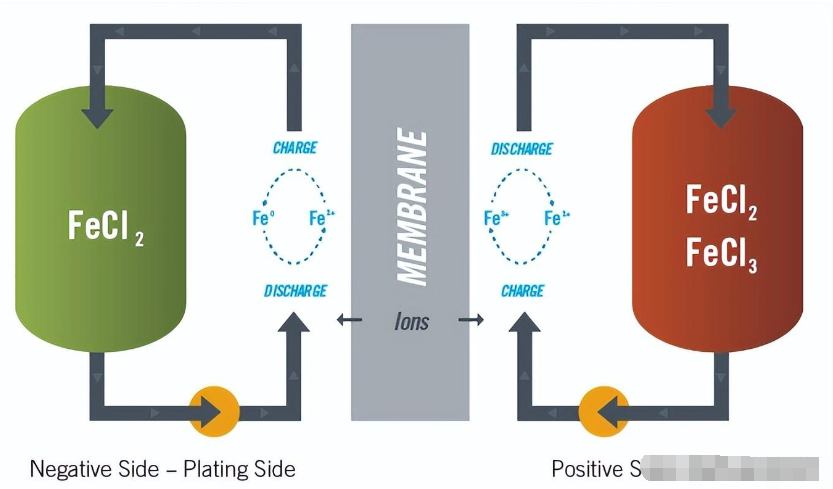
鐵液流電池可穩定進行無限次的深循環充電和放電循環,且性能為零。(圖片:ESS)
鐵液流電池 (IFB) 技術使用電解液中的鐵進行反應,包括發生電鍍的負電極(也稱為電鍍電極)和發生氧化還原反應的正電極(有時稱為氧化還原電極)。IFB電池的性能可以分解為電鍍電極性能(負極)、氧化還原電極性能(正極)和歐姆電阻損耗。在電鍍電極上,充電時亞鐵(Fe2+)離子獲得電子并以固態鐵的形式鍍在基板上,如上圖所示,固態鐵在放電時溶解為亞鐵離子并釋放出兩個電子。鍍鐵反應的平衡電位為-0.44V。
在氧化還原電極上,亞鐵和三價鐵 (Fe3+) 離子之間的氧化還原反應在充電和放電期間發生。在正極上,兩個 Fe2+ 離子在充電過程中失去兩個電子形成 Fe3+ 離子,兩個 Fe3+ 離子在放電過程中獲得兩個電子形成 Fe2+。亞鐵離子和三價鐵離子之間的平衡電位為+0.77V。IFB 氧化還原液流電池中的反應是可逆的。
溴化鋅
鋅溴液流電池在充電過程中,金屬鋅在碳塑復合電極的正極一側鍍成厚膜,溴離子在膜的另一側被氧化成溴并析出。在放電過程中,鋅金屬被氧化成 Zn2+ 離子并溶解到含水陽極電解液中。兩個電子在外部電路的陽極處釋放。電子返回陰極并將溴分子 (Br2) 還原為可溶于陰極電解液水溶液的溴離子。陰極電解液中的溴在陰極轉化為兩個溴化物(Br-)離子,平衡Zn2+陽離子,形成溴化鋅溶液。用于產生電流的化學過程增加了兩個電解液槽中的鋅離子和溴離子濃度。
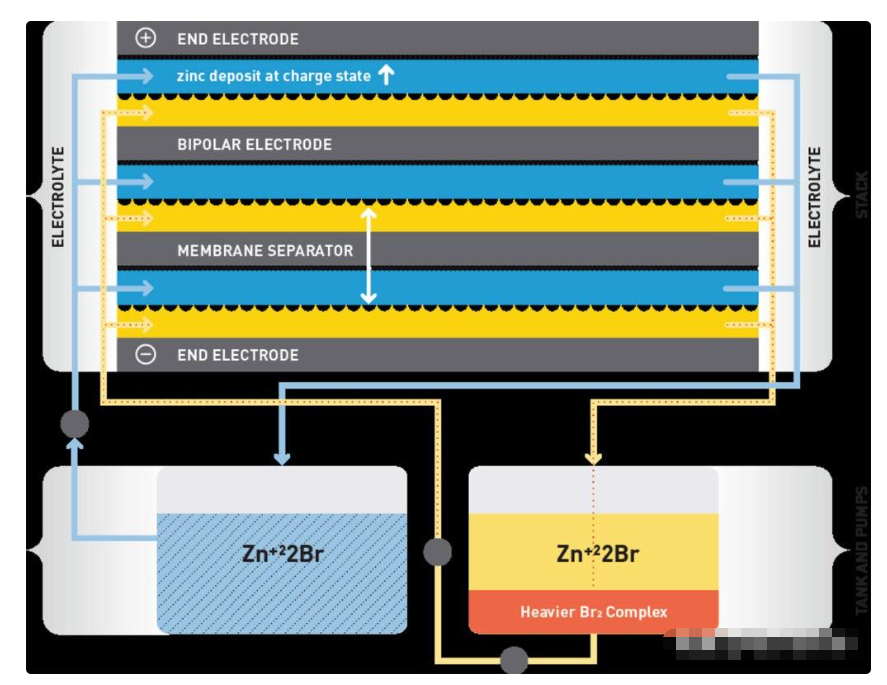
多節鋅溴液流電池的結構(圖片來源:Redflow)
釩
釩是一種不尋常的元素。它可以在溶液中以多種不同電荷的離子形式存在,V(2+,3+,4+,5+),每個離子的原子核周圍都有不同數量的電子。較少的電子導致較高的正電荷。在釩液流電池中,通過提供電子形成 V(2+,3+) 來儲存能量,通過失去電子形成 V(4+,5+) 釋放能量。因此,電解液中溶解的釩離子的不同氧化態(V2+、V3+、V4+、V5+)儲存或輸送電能。
電解液從儲罐系統連續輸送到反應池中。根據當前需求,能量存儲在電解質中(電池充電)或饋入電網/網絡(電池放電)。由于裝卸時電解液流動方向不必改變,施密德VRFB釩液流電池在響應時間上非常快(小于20ms)。可在滿載情況下在充電和放電之間切換。當系統處于待機模式時,電池組只會發生最小的放電。在電解液罐中,直到電解液通過打開泵再次流過電池堆時才會發生放電。
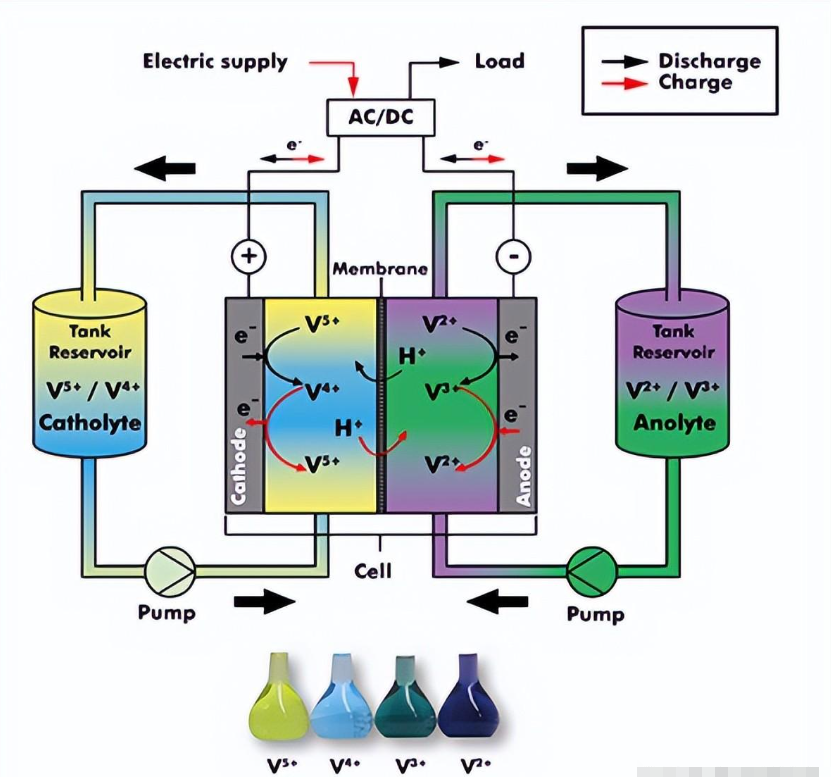
在釩氧化還原液流電池中,電解液中只有一種元素(釩)用于儲存能量。(圖片:施密德)
在釩氧化還原液流電池中,電解液中只有一種元素(釩)用于儲存能量。(來源:施密德)
這個由三部分組成的常見問題解答系列的第二部分將討論“液流電池——你能用它們做什么?
*博客內容為網友個人發布,僅代表博主個人觀點,如有侵權請聯系工作人員刪除。