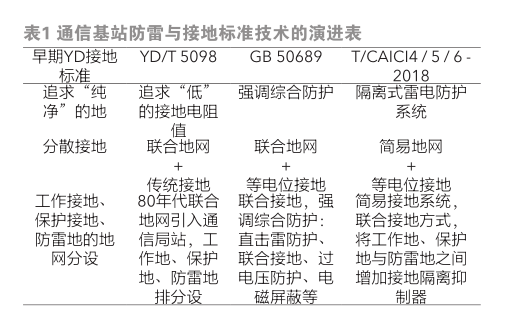
鋰錳電池材料的研究與進展
趙銘姝等以LiOH·H2O和MnO2為原料、采用分段加熱法制備尖晶石結構型材料,所得材料的初始放電容量達140mAh/g左右。
分段加熱法一般是根據對反應物的熱分析(熱重分析和差熱分析)來確定加熱溫度段的。一種反應物(一般為鋰鹽)處于熔融狀態時能更好地沉入到另一種反應物中,增大反應接觸面積,使固相反應更加充分,這與熔融鹽浸漬法在本質上是一致的。有些人在分段加熱過程中,還對產品進行研磨,其用意也是使反應物更加充分的接觸。
高英等人以Li2CO3和MnO2(EMD)為原料,先按一定比例混合,在700~900℃下燒結24h。自然冷卻后,研磨過篩,并在高溫700~900℃下燒結24~72h。自然冷卻得產物LiMn2O4。
電化學測試結果表明,這種材料的電池的初始放電容量可達120mAh/g。2.1.2加入輔助劑為了讓鋰鹽和錳鹽更好的混合,有些學者還提出輔以分散劑研磨混合的方法。例如在固體研磨過程中加入少量環己烷、乙醇或水,使混合更加均勻。
華黎明等用碳酸鋰和醋酸錳為原料,加入檸檬酸(或草酸)在研缽中充分研磨,于干燥箱中110℃下烘干2h。然后在馬弗爐中550℃下焙燒,得到尖晶石型LiMn2O4。產品粒度在28.5~40nm范圍內,首次放電容量可達115mAh/g。
康慨等人將硝酸鋰、醋酸錳和檸檬酸一起混合,于室溫(20±2)℃下研磨,置70~80℃烘箱中干燥,350~800℃焙燒,得到的產物在粒度大小及分布等方面均優于傳統高溫固相反應合成法的產物。
鄭子山等以醋酸錳和醋酸鋰為起始物,水溶液混合,加熱蒸發形成前驅體,而后焙燒。其產品初始容量可達128mAh/g。加入輔助溶劑,使粉體混合均勻,再進行分段加熱,這是目前普遍采用的改善固相反應的方法之一。此外,有學者還從粉體制備的設備上著手,通過改進反應條件,促進固相反應的進行。
2.1.3 球磨法
為使粉體反應物混合的更均勻,有人研究出了將原料先進行球磨活化處理的方法。葉世海等[16]對Li2CO3和MnO2原料,在研缽中研磨30min后,放入球磨罐內球磨,而后加熱焙燒,所得鋰錳氧化物的初始放電容量達到了120mAh/g,且大電流放電性能也得到了提高。
宋桂明等在球磨過程中加入有機分散劑,使產物成分均一,粉體粒度均勻,平均粒徑為11μm,初始充電容量為124mAh/g,放電容量為115mAh/g,循環30次放電容量還大于100mAh/g,循環性能良好。
盡管人們想盡辦法來改善固相反應中存在的粉體接觸不均勻、反應不充分等問題,但固相反應中始終難以達到原子或分子級的接觸。因此,固相法制備的產品粉體粒徑較大,且分布不均,顆粒有團聚現象,制備過程中有大量的鋰揮發損失。
所以,盡管固相法操作簡單,工業化程度高,但仍存在一定的局限性。
2.2 液相法
液相法是將鋰鹽與錳鹽混合成均一的溶液后再處理得到產物。此種方法的反應物是在分子級或原子級水平上的接觸,因此,反應產物較固相法均勻、粒徑較小。
2.2.1 溶膠2凝膠法
溶膠2凝膠法是典型的液相法。它是通過金屬離子與螯合劑形成均一螯合物,在較低溫度下得到金屬氧化物材料。
吳宇平等報道,在800℃下得到的LiMn2O4的可逆容量為135mAh/g(91%的理論容量)。彭正順等采用該法,在較低的溫度(低于250℃)下制得尖晶石型LiMn2O4材料。用此材料裝配的Li/LiMn2O4二次電池首次充放電容量超過130mAh/g,循環10次以后容量仍保持在120mAh/g。劉培松等人[20]在750℃下制得的粉體初始放電容量為120mAh/g,500次循環后還有115mAh/g。
溶膠2凝膠法制備溫度較低(一般低于800℃),產物粒徑小,分布均勻,具有較好的化學性能,但大都使用有機溶劑,這就使方法的成本較高,難于在工業中推廣。S.Sengup等[21]將Mn(CH3COO)2·4H2O和Li2CO3于去離子水中混合,然后在80℃時蒸發水分,220℃下加熱144h,其間每24h取出一次。此方法得到的粉體平均粒徑為5μm,電化學性能優于商業產品的性能。鄭子山等[22]將含有結晶水的醋酸鋰和醋酸錳溶液混合并加熱使形成前驅體,在250℃保溫1~2h,370℃燃燒4h,研磨過篩,850℃燒結10h,得到放電容量為128mAh/g的錳酸鋰粉體。該方法不使用有機絡合劑,為液相法的工業化提供了一個參考依據。
2.2.2 共沉淀法
共沉淀法的原理很簡單,就是加入沉淀劑,使鋰和錳同時從溶液中沉淀出來。常用的堿性沉淀劑有氨水、KOH等。另外,碳酸鹽(Na2CO3或Li2CO3)及一些有機酸類也可用于鋰鹽和錳鹽的沉淀劑。
郭炳焜等利用Mn(Ac)2與LiOH的反應,用氨水調節pH至7~8,此時溶液中析出沉淀,旋轉蒸發除去水分,得到凝膠前軀體。300℃下焙燒前驅體可得尖晶石型的LiMn2O4。H.
Huang等提出了以Li2CO3為原料替代需要在惰性氣氛下反應的LiOH原料,以草酸鹽為沉淀劑,生成的沉淀在不同溫度下煅燒后可得3V和4V級的電極材料。
在此基礎上,張國昀等[25]首次使用控制結晶2共沉淀法得到了高密度球形前驅體Mn3O4。
將其與LiOH·H2O在分散劑中研磨混合,750℃加熱20h,自然冷卻得到的產物的初始放電容量達128mAh/g,15次循環后仍有124mAh/g。
2.2.3 離子交換法
離子交換法即將鋰鹽與含錳的溶液混合,調節pH至生成沉淀,過濾,洗滌,烘干得前驅體,再在一定溫度下焙燒得產物。這種方法一般在制備層狀鋰錳化合物時廣泛采用。例如Armstrong等[26]通過離子交換法由α2NaMnO2制得了具有層狀鹽巖結構亞穩態的LiMnO2,Li/LiMnO2,電池充放電到4.3V時,其充放電容量達270mAh/g。
吳玉平報道,用LiOH與γ2MnOOH混合,在低溫(≤450℃)下加熱,所得材料在4.2~2.8V之間的可逆容量達190mAh/g,且循環性能良好。
2.3 微波合成法
無論液相法還是固相法,所制得的前驅體都要進一步煅燒,但傳統的煅燒方式一般都是從反應物外部加熱,所以產物均勻性受到一定限制,且有時易于結塊。因此有學者提出了用微波加熱的方法替代傳統的煅燒過程。
微波法以其獨特的優點(物體內部加熱,加熱均勻,不易結塊),克服了以往煅燒過程中耗時長、溫度高、加熱不均勻的問題,在燒結工藝上可謂獨辟蹊徑。
盧祥軍等采用微波加熱,在加熱時間低于15min,溫度750℃左右時制備出結晶良好的純尖晶石相的LixMn2O4。分析結果表明,x=1.05時,材料性能最好,其初始容量為147mAh/g,循環性能良好。
嚴宏偉等以LiOH和MnO2為原料,按一定比例混合壓片后置于莫來石泡沫保溫磚容器中,再放入家用微波爐中加熱一段時間后隨爐冷卻,制得納米級LiMn2O4粉末。該粉末晶粒均勻,粒徑為1~2μm,相純度高,電化學可逆容量達130mAh/g。
另外,楊書廷等采用微波2高分子網絡法(m2p)法,以Li2CO3和Mn(NO)2為原料,以聚丙烯酰胺為高分子網絡劑制得前驅體,用微波加熱法合成了納米級尖晶石型LiMn2O4粉體。該材料比容量為120mAh/g,循環50次后衰減率僅為4.7%,顯示了較好的效果。
3 結語
錳系正極材料與其它的正極材料相比,無論是從環境污染,還是從性能價格比來看,都具有明顯的優越性,應用前景非常誘人,但其在使用過程中的循環性能和儲存性能的局限性一直限制著它的工業化進程。因此,有必要深入研究其容量損失機理(尤其是Mn的溶解機理)。今后應針對此種材料電極的一些缺點,如在電解液中會逐漸溶解,發生岐化反應;深度放電過程中,當錳的平均化合價為3.5時,會發生Jahn2Teller效應,變形扭曲,使尖晶石型晶格在體積上發生變化,電極成分丟失,導致電極在多次循環后容量衰減等方面進一步開展工作。目前主要是在制備、摻雜等各方面尋求解決此弊端的有效途徑。因此,此領域的研究頗具現實意義。隨著材料工藝和設備的不斷更新,這方面的研究有望進一步深入和提高,這種正極材料的性能也會得到明顯改善。









評論