JMP Clinical of SAS幫助FDA及SFDA改進藥物評審
據悉,繼美國食品與藥物管理局(FDA)正式使用JMP Clinical of SAS之后,中國食品藥品監督管理局(SFDA)也正式開始使用JMP Clinical產品,用于新藥評審環節的數據分析及其他相關生物統計應用。
本文引用地址:http://www.104case.com/article/136562.htmJMP Clinical 是SAS公司應FDA的要求于2010年正式推出的新一代生命科學數據分析平臺,特別適用于藥物臨床試驗數據的分析。它推出后,成為SAS公司JMP產品系列繼JMP,JMP Pro,JMP Genomics之后的第四個主要產品,它可以幫助簡化臨床試驗數據的安全性評審,縮短昂貴而繁瑣的藥物開發過程。
據了解,美國FDA的評審員在藥物審評中廣泛使用JMP多年,目前有超過40%的評審員在使用該系列軟件進行數據審查和分析,包括對制藥企業提交的新藥申請報告進行評審。目前,FDA在評審環節中,對于非數據的部分,主要借助Microsoft Office及PDF等軟件進行評審,而對于數據,則主要使用JMP、JMP Clinical和SAS。而SAS軟件早已是生命科學數據分析領域事實上的標準軟件,JMP、JMP Clinical和SAS都已經被全球各大藥廠在化合物發現、藥理及毒理分析、藥代動力學、生物等效性、臨床試驗、藥物評審、藥物制造質量管理等領域廣泛使用。借鑒國外的經驗,SFDA藥品審評中心近期也正式導入了JMP Clinical,以進一步改進我國的藥品審評工作,這將對我國的制藥企業乃至整個生命科學行業產生廣泛、積極的影響。
JMP Clinical是JMP 產品和SAS產品的完美結合。它由JMP及其專為臨床試驗數據分析開發的Clinical模塊、以及幾個核心的SAS程序包組成,既能滿足傳統用戶喜歡編寫和運行SAS Code的習慣,又充分發揮JMP交互式可視化數據分析的特性,使數據分析效率(如分析藥物臨床試驗中的不良事件、患者檔案等)成倍提高。
此外,JMP Clinical 還完全支持越來越被廣泛接受的CDISC臨床分析與報告標準,幫助用戶組織評審流程,自動進行后臺分析和報告,讓用戶有更多的時間去解釋和理解分析結果。它還是目前自身能夠理解ADaM數據的首批工具之一,幫助評審員和生物統計學家順利進入到現代評審環境。
JMP Clinical的用戶包括醫學評審員,流行病學家、數據監查員,生物統計學家和生物測定學團體等等。
JMP Clinical中專為臨床試驗數據開發的Clinical模塊
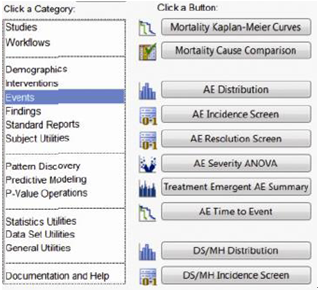
美國Gilead Sciences Inc.公司的統計規劃和生物測定部高級總監Steve Wong 先生這樣評價JMP Clinical:“很早以前我們就清楚地認識到,JMP Clinical將幫助我們在藥物批準流程中獲得更快的周轉速度。我相信JMP Clinical的確是JMP產品群又一個令人喝彩的精品。”







評論