科學(xué)家設(shè)計(jì)主動(dòng)滲透納米載體,完美平衡藥物釋放和轉(zhuǎn)胞運(yùn)作用,助力研發(fā)抗腫瘤納米新藥
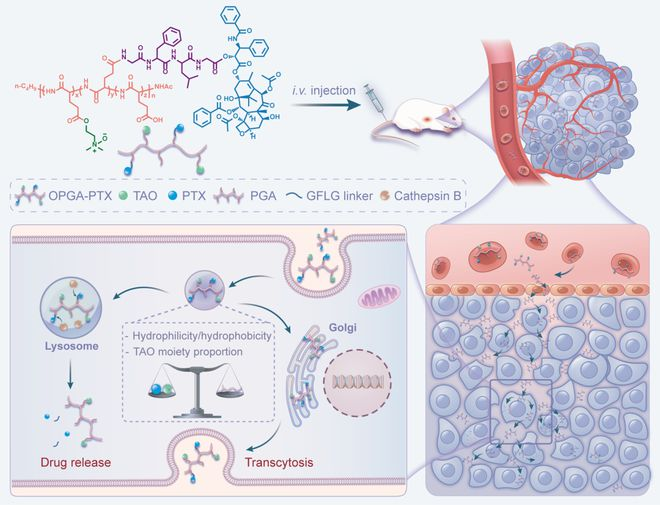
近日,浙江大學(xué)相佳佳研究員和團(tuán)隊(duì)研制出一種三級(jí)胺氧化物修飾的聚谷氨酸-紫杉醇鍵合物(OPGA-PTX)。
通過調(diào)控該鍵合物載體的化學(xué)結(jié)構(gòu),可以優(yōu)化其細(xì)胞內(nèi)分布,從而起到平衡細(xì)胞內(nèi)藥物釋放和轉(zhuǎn)細(xì)胞的作用。

圖 | 相佳佳(來源:相佳佳)
細(xì)胞內(nèi)藥物釋放和轉(zhuǎn)胞運(yùn)的平衡問題,是此前轉(zhuǎn)胞運(yùn)納米藥物設(shè)計(jì)方面一個(gè)久被忽視、但又十分重要的問題。
這項(xiàng)工作中,他們提出一種新型的納米藥物設(shè)計(jì)策略,即在設(shè)計(jì)載體化學(xué)結(jié)構(gòu)以行使各項(xiàng)功能時(shí),考慮利用生物體或細(xì)胞本身的機(jī)制和通路,賦予載體智能化的特性。
也就是利用載體在不同細(xì)胞器中的分布,解決藥物釋放和轉(zhuǎn)胞運(yùn)的問題。通過此,可以為設(shè)計(jì)兼具高效轉(zhuǎn)胞運(yùn)作用和抗腫瘤作用的納米藥物提供新思路。
這既能解決當(dāng)前納米藥物的腫瘤滲透瓶頸,讓納米藥物能被遞送至腫瘤細(xì)胞甚至遠(yuǎn)端細(xì)胞,同時(shí)藥物也能在腫瘤細(xì)胞內(nèi)得到有效釋放,從而殺死腫瘤細(xì)胞。
據(jù)相佳佳介紹,這項(xiàng)成果是在聚谷氨酸-紫杉醇的基礎(chǔ)上改進(jìn)而來。其化學(xué)結(jié)構(gòu)比較簡(jiǎn)單,而且聚氨基酸的生物相容性比較好,具有不錯(cuò)的轉(zhuǎn)化前景。
未來,該團(tuán)隊(duì)將進(jìn)一步拓展本次體系,在動(dòng)物模型上進(jìn)行試驗(yàn)和推進(jìn)轉(zhuǎn)化進(jìn)程。
此外,他們也在積極拓展本次體系在其他疾病模型上的應(yīng)用。比如,通過滴眼給藥治療眼部疾病,以及通過口服治療腸道疾病等。
(來源:Advanced Materials)

胞內(nèi)截留和細(xì)胞間轉(zhuǎn)運(yùn)的平衡難題
據(jù)介紹,納米藥物能夠有效降低藥物的副作用,提高一些難溶藥物或易降解藥物的生物利用度。
當(dāng)把納米藥物經(jīng)靜脈注射之后,通常需要經(jīng)歷五個(gè)復(fù)雜的級(jí)聯(lián)步驟(CAPIR):
在全身血液中的循環(huán)(Circulation);
逐漸蓄積到腫瘤組織(Accumulation);
滲透到無血管的腫瘤組織和遠(yuǎn)端腫瘤細(xì)胞(Penetration);
隨后被細(xì)胞內(nèi)化(Internalization);
最后釋放藥物殺死腫瘤細(xì)胞(Release)。
納米藥物的整體遞送效率,主要取決于這五個(gè)步驟。但是,實(shí)體瘤本身情況十分復(fù)雜:其腫瘤微環(huán)境中的細(xì)胞外基質(zhì)十分致密、血管分布混亂,腫瘤細(xì)胞密集堆積、間質(zhì)流體壓力高。
這些因素導(dǎo)致腫瘤滲透成為納米藥物難以克服的瓶頸,也是當(dāng)前納米藥物臨床療效低的主要原因之一。
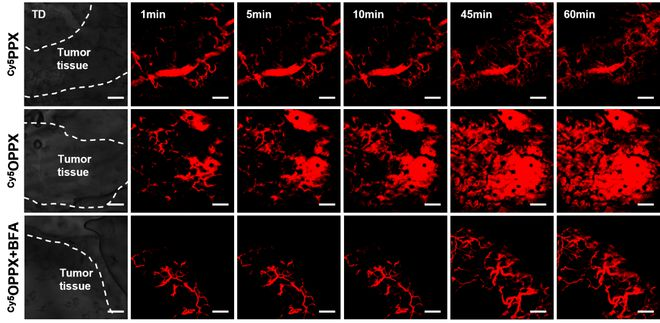
該課題組在 2019 年首次提出,利用細(xì)胞內(nèi)在的轉(zhuǎn)胞運(yùn)作用來跨細(xì)胞遞送納米藥物,以繞開腫瘤組織致密的細(xì)胞外基質(zhì),并證明這是一種能克服實(shí)體瘤滲透屏障和實(shí)現(xiàn)腫瘤深層滲透的有效手段。
前期研究發(fā)現(xiàn),腫瘤特異性酶響應(yīng)的電荷反轉(zhuǎn)聚合物以及三級(jí)胺氧化物聚合物載體,能夠有效促進(jìn)納米藥物的腫瘤滲透效果。
但是,目前關(guān)于載體誘導(dǎo)細(xì)胞轉(zhuǎn)胞運(yùn)作用的研究,主要集中在提升轉(zhuǎn)運(yùn)性能,以讓其在被細(xì)胞攝取之后,盡可能地被運(yùn)至高爾基體或內(nèi)質(zhì)網(wǎng)等具有外泌功能的細(xì)胞器。
然而,腫瘤細(xì)胞需要截留部分納米藥物、或截留部分釋放的藥物,以便在完成轉(zhuǎn)胞運(yùn)之后,誘導(dǎo)腫瘤細(xì)胞死亡。
因此,如何實(shí)現(xiàn)藥物胞內(nèi)截留和細(xì)胞間轉(zhuǎn)運(yùn)之間的平衡,從而獲得藥物釋放和腫瘤滲透之間的協(xié)調(diào),進(jìn)而使腫瘤治療效果達(dá)到最佳,仍然是一項(xiàng)挑戰(zhàn)。
基于此,該團(tuán)隊(duì)設(shè)計(jì)了這種新型的聚谷氨酸-紫杉醇鍵合物(OPGA-PTX),其具有不同的親疏水比和三級(jí)胺氧化物含量,并以組織蛋白酶 B 響應(yīng)的多肽序列作為藥物連接子。
(來源:Advanced Materials)

能在幾乎不影響小鼠體重情況下顯著抑制腫瘤生長(zhǎng)
事實(shí)上,本項(xiàng)研究的初版思路和終版思路存在很大差別。
此前,聚谷氨酸-紫杉醇鍵合物已經(jīng)進(jìn)入過臨床研究,但是最終仍以失敗告終。該團(tuán)隊(duì)分析其中一個(gè)原因是藥物在腫瘤的富集和滲透不佳所導(dǎo)致的。
因此,他們想把課題組之前開發(fā)的一種三級(jí)胺氧化物,修飾到聚谷氨酸-紫杉醇鍵合物上,以增強(qiáng)它的腫瘤滲透性能。
然而,他們發(fā)現(xiàn)所設(shè)計(jì)的藥物鍵合物,被細(xì)胞內(nèi)吞之后不僅會(huì)分布在高爾基體中,在溶酶體中也有大量分布,這與設(shè)計(jì)初衷是相悖的。
而在該團(tuán)隊(duì)的前期工作中,所設(shè)計(jì)的具有轉(zhuǎn)胞運(yùn)作用的聚合物,往往在高爾基體中有著較高的分布,而在溶酶體中則呈現(xiàn)出非常少的分布。
因此,他們意識(shí)到上述現(xiàn)象很可能是由于鍵合物的結(jié)構(gòu)導(dǎo)致的。也就是說,載體親疏水性以及三級(jí)胺氧化物的修飾比例,有可能是主要的影響因素。
于是,他們開始轉(zhuǎn)換思路:能否通過優(yōu)化聚合物的結(jié)構(gòu),來調(diào)控納米藥物在高爾基體和溶酶體中的分布?
之所以這樣設(shè)想,是基于:高爾基體與轉(zhuǎn)胞運(yùn)作用密切相關(guān),而溶酶體則是發(fā)揮胞內(nèi)降解作用的重要細(xì)胞器。
當(dāng)納米藥物并被細(xì)胞內(nèi)吞之后,部分能轉(zhuǎn)運(yùn)至高爾基體,從而發(fā)揮轉(zhuǎn)胞運(yùn)作用;同時(shí)部分納米藥物可以被溶酶體截留,響應(yīng)組織蛋白酶 B 進(jìn)而釋放活性藥物,最終殺死頑固的腫瘤細(xì)胞。
基于此,該團(tuán)隊(duì)通過調(diào)節(jié)鍵合物的親疏水比例和三級(jí)胺氮氧基團(tuán)含量,來優(yōu)化其在細(xì)胞內(nèi)的分布。
細(xì)胞實(shí)驗(yàn)結(jié)果表明:親疏水比例和三級(jí)胺氮氧基團(tuán)含量,對(duì)鍵合物的內(nèi)吞、亞細(xì)胞分布和轉(zhuǎn)胞運(yùn)作用產(chǎn)生決定性影響。
他們由此篩選出最符合預(yù)期的紫杉醇鍵合物:它可以被細(xì)胞快速內(nèi)吞,在溶酶體和高爾基體中具有較為平衡的分布,并能發(fā)揮快速轉(zhuǎn)胞運(yùn)和腫瘤滲透能力。
對(duì)于篩選出來的紫杉醇鍵合物,課題組在動(dòng)物水平上考察其是否具有良好的血液循環(huán)能力、腫瘤血管外滲和腫瘤滲透能力。
結(jié)果發(fā)現(xiàn)在動(dòng)物實(shí)驗(yàn)中,所篩選的紫杉醇鍵合物的確展現(xiàn)出優(yōu)異的能力,這為進(jìn)一步開展體內(nèi)抗腫瘤實(shí)驗(yàn)打下了基礎(chǔ)。
而在體內(nèi)抑瘤活性實(shí)驗(yàn)中,相比對(duì)照組,目標(biāo)紫杉醇鍵合物也展現(xiàn)出更好的抗腫瘤效果,能在幾乎不影響小鼠體重的情況下顯著抑制腫瘤生長(zhǎng)。
這表明本次設(shè)計(jì)的紫杉醇鍵合物,具有良好的生物安全性和抑瘤活性。
此外,相佳佳表示:“本項(xiàng)研究的絕大部分工作由課題組的一名碩士生和一名博士生合作完成,分別負(fù)責(zé)生物學(xué)表征和聚合物載體合成。”
讓他印象最深刻的是這位碩士生,這名女生幾乎從零開始入門,獨(dú)立完成了所有細(xì)胞實(shí)驗(yàn)和動(dòng)物實(shí)驗(yàn)的驗(yàn)證工作。
剛加入實(shí)驗(yàn)室的時(shí)候,她幾乎不懂細(xì)胞也非常害怕小鼠,高分子載體設(shè)計(jì)的知識(shí)也比較薄弱。
“期間,她經(jīng)歷了許多次的實(shí)驗(yàn)失敗再重來,也經(jīng)歷了多次自我信心的不斷重建。”相佳佳說。
當(dāng)發(fā)現(xiàn)本次聚合物和課題組此前設(shè)計(jì)的轉(zhuǎn)胞運(yùn)觸發(fā)型載體,在溶酶體和高爾基體中存在巨大分布差異時(shí),這名女生非常崩潰,一度考慮是否放棄課題,畢竟當(dāng)時(shí)還面臨著畢業(yè)的壓力。
“好在她堅(jiān)持下來了,那段時(shí)間我們不斷地討論和嘗試,逐漸提出最終的研究思路,即通過優(yōu)化聚合物的化學(xué)結(jié)構(gòu),來調(diào)節(jié)聚合物在高爾基體和溶酶體中的分布,以便平衡納米藥物轉(zhuǎn)胞運(yùn)和胞內(nèi)釋放。”相佳佳說。
如今,這名女生的細(xì)胞實(shí)驗(yàn)技能和動(dòng)物實(shí)驗(yàn)技能也愈加?jì)故欤朔藢?duì)小鼠的恐懼,科研水平也得到質(zhì)的提升,目前正在香港科技大學(xué)攻讀博士學(xué)位。
另外,相關(guān)論文也于近期以《調(diào)節(jié)細(xì)胞內(nèi)動(dòng)力學(xué)以優(yōu)化細(xì)胞內(nèi)釋放和轉(zhuǎn)胞吞平衡》(Modulating Intracellular Dynamics for Optimized Intracellular Release and Transcytosis Equilibrium)為題發(fā)在 Advanced Materials[1]。
袁桂萍和李明輝是第一作者,相佳佳和浙江大學(xué)申有青教授擔(dān)任共同通訊作者。

圖 | 相關(guān)論文(來源:Advanced Materials)
不過,研究中他們也發(fā)現(xiàn)該鍵合物依舊存在一些不足,因此后續(xù)要繼續(xù)優(yōu)化結(jié)構(gòu),在大動(dòng)物模型上進(jìn)行驗(yàn)證。同時(shí),還得考慮相關(guān)藥物的放大生產(chǎn),盡可能地推進(jìn)臨床轉(zhuǎn)化。
另外,相佳佳表示:“AI for Material Design 一定是未來的趨勢(shì),我們課題組當(dāng)然也不會(huì)錯(cuò)過這樣一個(gè)機(jī)遇,要抓緊上船,目前也正在開展這方面的工作。”

參考資料:
1.Yuan, G., Li, M., Zhang, Y., Dong, Q., Shao, S., Zhou, Z., ... & Shen, Y. (2024). Modulating Intracellular Dynamics for Optimized Intracellular Release and Transcytosis Equilibrium. Advanced Materials, 2400425.
運(yùn)營(yíng)/排版:何晨龍
*博客內(nèi)容為網(wǎng)友個(gè)人發(fā)布,僅代表博主個(gè)人觀點(diǎn),如有侵權(quán)請(qǐng)聯(lián)系工作人員刪除。



