北航團隊研發生物降解 “電子繃帶”,小鼠腸道損傷14天內完全愈合,加速多種器官的傷口愈合
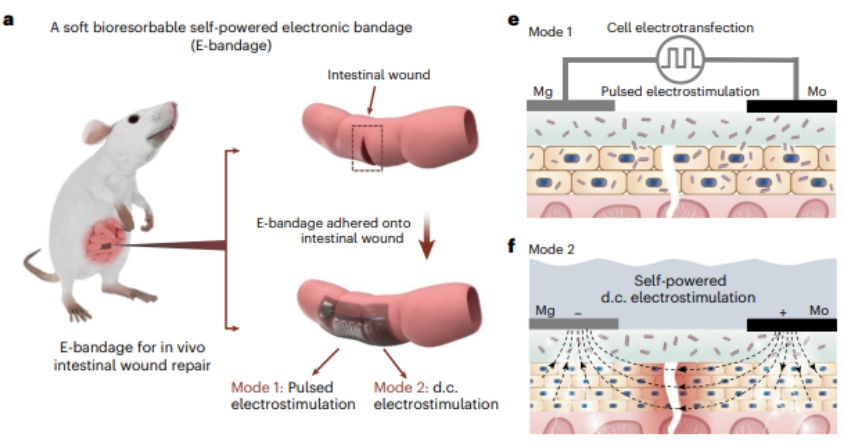
近日,北京航空航天大學常凌乾團隊,設計了一種自供電柔性電刺激微電極系統(稱為“電子繃帶”)。
其具備全植入式和可生物降解的特點,大約可以在體內存在數周時間,實現其生物學功能(即促進腸道損傷愈合)后全部降解。

圖 | 常凌乾(來源:常凌乾)
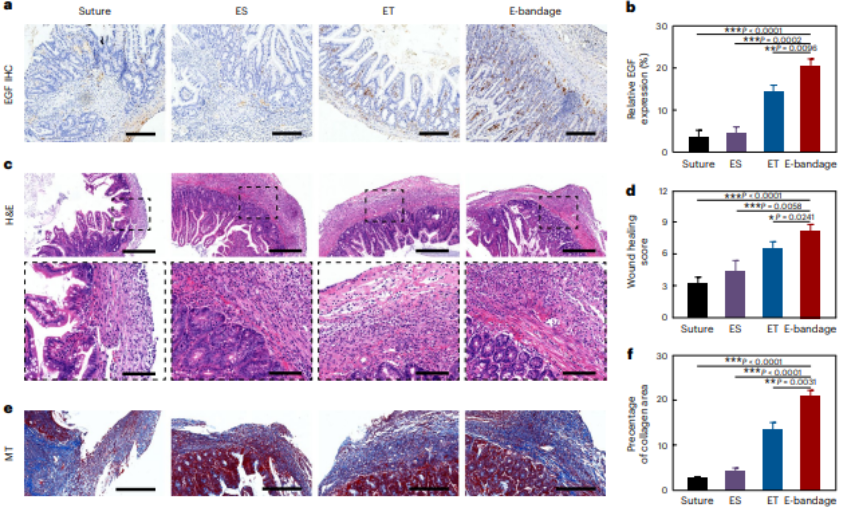
當將電子繃帶用于小鼠腸道損傷模型之中,脈沖電刺激可以將生長因子(EGF,Epidermal Growth Factor)基因,高效地表達到腸道上皮細胞中。
同時,直流電刺激可以持續地刺激細胞,將細胞內產生的大量 EGF 蛋白分泌至細胞外。
在這種協同作用之下,小鼠腸道在電子繃帶植入 14 天之內完成良好愈合。與傳統手術縫合相比,增生和梗阻等術后并發癥的概率顯著減少,并且修復之后的小鼠腸道組織,在粘膜連續性、肌肉連續性和肉芽組織形成上表現良好。
當對小鼠糞便進行菌群測序分析之后,電子繃帶顯示出較高的益生菌相對豐度和活力水平。
(來源:Nature Electronics)
在整個生物降解期之內,被植入電子繃帶的健康小鼠血清中的 C 反應蛋白和白細胞介素-2(IL-2),相比未植入電子繃帶的健康小鼠,沒有出現明顯差異。
同時,植入小鼠的心臟、肝臟、脾臟、肺、腎臟沒有發現明顯的炎癥反應,這證明電子繃帶具備良好的生物兼容性。
此外,電子繃帶使用鎂和鉬的微電極對,且金屬含量均遠低于每日推薦的膳食攝入量,不會對生物體造成傷害。
同時,這兩種材料都具備可生物降解的特點,是理想的植入式器件的電極材料。
總的來說,憑借這款電子繃帶的雙電刺激策略,為加速傷口愈合提供了一條富有潛力的途徑。
雖然本次工作僅僅展示了小鼠腸道傷口的愈合案例。但也可以用于促進其他器官和組織的傷口愈合,包括神經系統、皮膚和肌肉等。
(來源:Nature Electronics)

據了解,腸道的結構比較獨特,而且微環境比較復雜。因此,其傷口愈合是一項具有挑戰性的醫學問題。
縫合手術是常用的傳統治療方案,但可能會導致恢復時間長、以及腸道增生和梗阻等術后并發癥。手術釘和壓迫吻合環,盡管可以作為替代方案,但也可能會導致更多的組織損傷。
傷口要想成功愈合,就需要促進關鍵細胞的增殖。而攜帶干細胞和愈合因子的組織密封劑或水凝膠,可能具備加速愈合的能力。
然而,組織密封劑或水凝膠不能主動調節細胞內基因表達、胞外分泌和細胞外微環境中的增殖。
這種情況之下,無法加速傷口部位所必需的細胞增殖,自然也就無法有效地干預傷口愈合過程。
電刺激,此前已被用于促進淺表組織和器官的愈合。不過,一些現有的技術挑戰阻礙了臨床應用。
比如說,對于電刺激這種手段來說,必須使用一個可植入的可控電源,來按需提供電刺激。
隨后,讓可控電源在生物體內完成自降解。這種方法盡管無需二次手術摘除,但是依然未能得到實現。
而在本次研究伊始,課題組在細胞實驗中進行了一系列脈沖電刺激的探究,通過此他們發現用于細胞增殖的 EGF 基因,不僅具備較高的遞送效率,并且可以很好的轉率和翻譯。
但是,這樣的增殖效率似乎并不能達到理想效果。考慮到細胞增殖的機理在于生長因子蛋白必須要被分泌至細胞外,與鄰近細胞表面受體結合才能起到最終的作用。
因此,他們推測通過單純的脈沖電刺激來提高胞內 EGF 含量,并不能明顯地提高胞吐的能力。
于是,他們開始研究電刺激的作用時間長短,是否能夠影響到細胞的胞吐行為。通過延長脈沖電刺激的時間,該團隊發現細胞的增殖速率果然得到了進一步提高。
但這顯然是不現實的,因為手術窗口期是有限的,顯然無法通過脈沖電刺激實現這一功能。
鑒于此,他們打算尋找一種既可以持續輸出電刺激、且不管強度多大都可以實現自驅動的電刺激,同時還得適應需要完全植入生物體內的應用場景。
后來,他們發現基于原電池原理的生物可吸收金屬材料,或許能夠實現這一需求。通過測試和篩選,課題組鎖定了鎂和鉬這兩種金屬。
與此同時,以這兩種金屬為導向的微電極對,還可以作為脈沖電轉染的正負極。
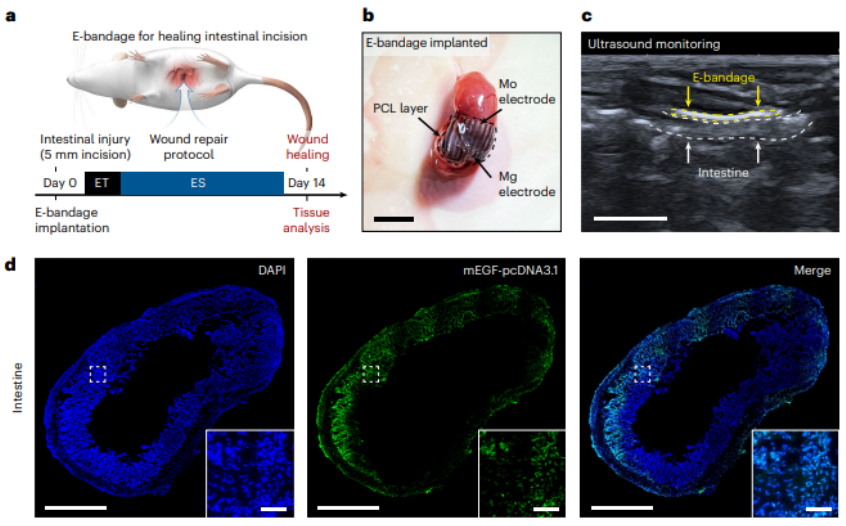
接下來,他們通過在小鼠腸道損傷模型中,初步驗證了該系統的可行性。
經過一段時間的試錯,課題組發現相比臨床手術縫合線的方式,在術后發生梗阻和增生等方面,這種雙電刺激合璧的系統具有明顯的優勢。
并且,相比只是單一種電刺激的情況下,其愈合療效也非常出色。
(來源:Nature Electronics)

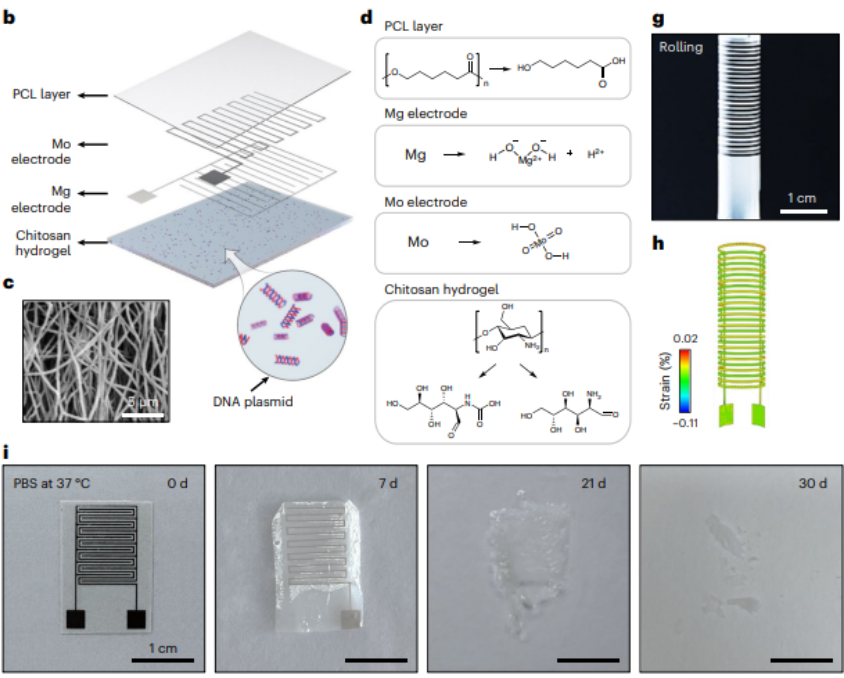
據介紹,電子繃帶由三層結構組成,其中的所有材料都具有生物可降解性:
第一層是多孔聚己內酯薄膜,也是本次系統的基底層。通過靜電紡絲工藝,上述薄膜可以形成纖維網絡。
第一層主要有兩大作用:
其一,可以支撐鎂/鉬電極沉積在薄膜表面;其二,可以作為電子繃帶的封裝,延長器件的使用壽命。
第二層是鎂和鉬形成的微叉指電極對。其中,電極層通過陰影掩模磁控,濺射在聚己內酯基底之上。
第二層也主要有兩大作用:
其一,可以通過術中施加脈沖電刺激,從而充當正負電極對的作用,進而用于一次性的基因遞送,以便將含有 EGF 片段的 DNA 質粒,遞送到腸道上皮細胞中,促進細胞對外源 EGF 基因進行有效轉錄和翻譯。
其二,鎂/鉬兩種金屬的電極在體液環境中,可以形成一個原電池,從而持續地向組織部位釋放大約 1V 的直流電刺激。
第三層是殼聚糖水凝膠層,能通過勻膠儀旋涂在微電極的另一側。
第三層的兩大作用如下:
其一,殼聚糖水凝膠可以直接接觸腸道組織,其本身的粘性可以將電子繃帶牢固地粘附在腸道傷口位置。
其二,水凝膠的三維多孔狀結構,可以吸附和儲存 EGF 基因溶液,以便用于脈沖電轉染。
而采用雙電模態刺激促進腸道損傷修復的機理,則可分為兩個方面:
一方面,通過脈沖電場,將含有 EGF 基因的質粒遞送到細胞內部,促使細胞進行轉錄和翻譯,從而增加 EGF 的蛋白表達量。
對于傷口愈合來說,只有 EGF 蛋白這樣的愈合因子分泌到胞外,與鄰近細胞表面受體結合,才能起到愈合作用。
另一方面,鎂/鉬電極在體液環境中所形成的原電池,可以持續地釋放直流電場,當對損傷位置的細胞進行電刺激時,就能促使細胞離子通道打開,從而增強蛋白質的胞吐作用。
進而將大量的 EGF 源源不斷地分泌到細胞之外,最終達到雙重電刺激的協同作用,借此促進上皮細胞的增殖,進而加速組織傷口的愈合。
相比縫合、藥物聯用、以及使用單電模態(脈沖或直流)刺激的電子繃帶等方法,這種基于雙電刺激協同作用的電子繃帶和上述三者存在以下不同之處:
首先,對于雙電刺激電子繃帶和基于縫合加藥物的治療來說,應該使用含有 EGF 蛋白的敷料一類藥物。
但是,由于 EGF 蛋白的半衰期非常短,無法有效地避免干預傷口愈合的過程。因此,促進傷口愈合的程度會受到很大限制,導致無法達到理想的愈合結果。
其次,對于雙電刺激電子繃帶和單次電刺激電子繃帶的區別來說,主要需要分為兩種情況。
第一種情況,脈沖電刺激盡管可以提升細胞內 EGF 蛋白的總量,但是由于電刺激作用時間非常短暫(幾十秒),因此無法將足夠的 EGF 蛋白排向胞外。這樣一來,就會導致細胞增殖結果不明顯,傷口愈合情況自然也就不理想。
第二種情況,直流電刺激的確可以促進細胞發生胞吐行為。但是,由于細胞自身所產生的 EGF 蛋白非常有限,同樣也會導致細胞外能用于增殖的 EGF 蛋白總量較少,最終依舊無法實現細胞增殖,進而無法有效地促進傷口修復。
而基于雙電刺激的電子繃帶,巧妙地彌補了以上缺陷,讓局部源源不斷地產生大量 EGF 蛋白,發揮促進愈合的作用。
相比傳統方案,這種提高自體分泌 EGF 的策略,不僅能縮短愈合時間,還能減少增生、梗阻等并發癥,并能提高腸道微環境健康。
(來源:Nature Electronics)

有時,一項成功的科研常會伴隨著酸甜苦辣和崎嶇坎坷。
論文一作(吳晗,北航三年級博士生)對該研究感慨頗多:“2021 年冬天,因為要對電子繃帶植入小鼠體內后做超聲檢測,我和王玉瓊師姐顧不上吃晚飯,抱著剛麻醉后的小鼠。”
北京的冬天很冷,王玉瓊將老鼠捂在懷里,生怕低溫老鼠去世。
吳晗繼續說道:“這里要特別感謝王思奇哥(王玉瓊師姐老公),開車送我們去做小動物超聲影像,暖風開到最大,一路顫顫巍巍。”
很幸運的是他們拍成了,不幸的是就在回實驗室的路上,小老鼠沒能抵抗住寒冷的天氣壯烈犧牲了。“師姐說,這或許就是科研人的艱辛和不易,一切都得重頭再來嘍。”論文一作表示。
當然,最終的結果是美好的。相關論文以《通過柔軟且可生物降解的電子繃帶的雙重電刺激加速腸道傷口愈合》(Accelerated intestinal wound healing via dual electrostimulation from a soft and biodegradable electronic bandage)為題發在 Nature Electronics(IF 34.3)。

圖 | 相關論文(來源:Nature Electronics)
北航的吳晗博士生、王玉瓊博士、李虎博士(現為香港城市大學博士后)是共同一作,北航的常凌乾教授和助理教授王柳、以及美國賓夕法尼亞州立大學余存江教授擔任共同通訊作者[1]。

圖 | 從左到右:常凌乾、吳晗、王玉瓊、李虎(來源:資料圖)
和藥物上市相似的是,假如自供電電子繃帶要進行人體實驗,就得開展臨床試驗。
鑒于電子繃帶屬于醫療器械,因此要遵從國家藥品監督管理局組織制定的《醫療器械動物試驗研究注冊審查指導原則》和 GB/T 16886 一系列標準。
并根據醫療器械生物學評價相關的技術文件,開展進一步的大型動物實驗,比如豬和靈長類動物的實驗。
基于目前的研究,下一步他們計劃在現有芯片系統基礎之上,針對修復過程中的傷口進行實時監測,并希望能做到隨時診斷、及時治療的一體化集成系統。
在本次研究之中,他們發現雖然自供電電子繃帶有很好的促愈合療效,但是這種結果也只能在術后特定時間去觀察最終的治療效果。

參考資料:1.Wu, H., Wang, Y., Li, H.et al. Accelerated intestinal wound healing via dual electrostimulation from a soft and biodegradable electronic bandage. Nat Electron (2024). https://doi.org/10.1038/s41928-024-01138-8
運營/排版:何晨龍


*博客內容為網友個人發布,僅代表博主個人觀點,如有侵權請聯系工作人員刪除。


