DeepMind劃時代杰作!AlphaFold蛋白結構預測擊敗人類奪冠
AI如何成功預測蛋白質3D結構?
本文引用地址:http://www.104case.com/article/201812/395247.htm此次讓DeepMind再一次嶄露頭角的CASP, 被認為是蛋白質結構領域“奧林匹克競賽”。在這次比賽上,DeepMind團隊(參賽名為“A7D”)成功在43個參賽蛋白中拿到25個單項最佳模型,累計總分120.35排名第一。
而根據第13屆全球蛋白質結構預測競賽官方披露的成績,總分第2名的團隊是一支名為“Zhang”的團隊,總分為107.03。
據DeepMind介紹,該項成果的設計源于使用神經網絡預測物理特性以及構建蛋白質結構預測的新方法。
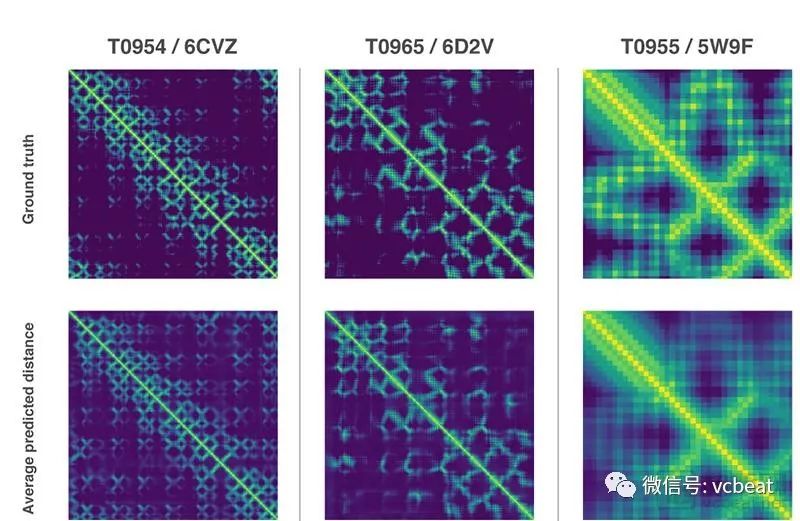
這兩種方法都依賴于深度神經網絡,這些神經網絡經過訓練可以從其基因序列中預測蛋白質的特性。DeepMind的網絡預測的屬性是:(a)氨基酸對之間的距離和(b)連接這些氨基酸的化學鍵之間的角度。第一個發展是對常用技術的進步,這些技術估計氨基酸對是否彼此接近。
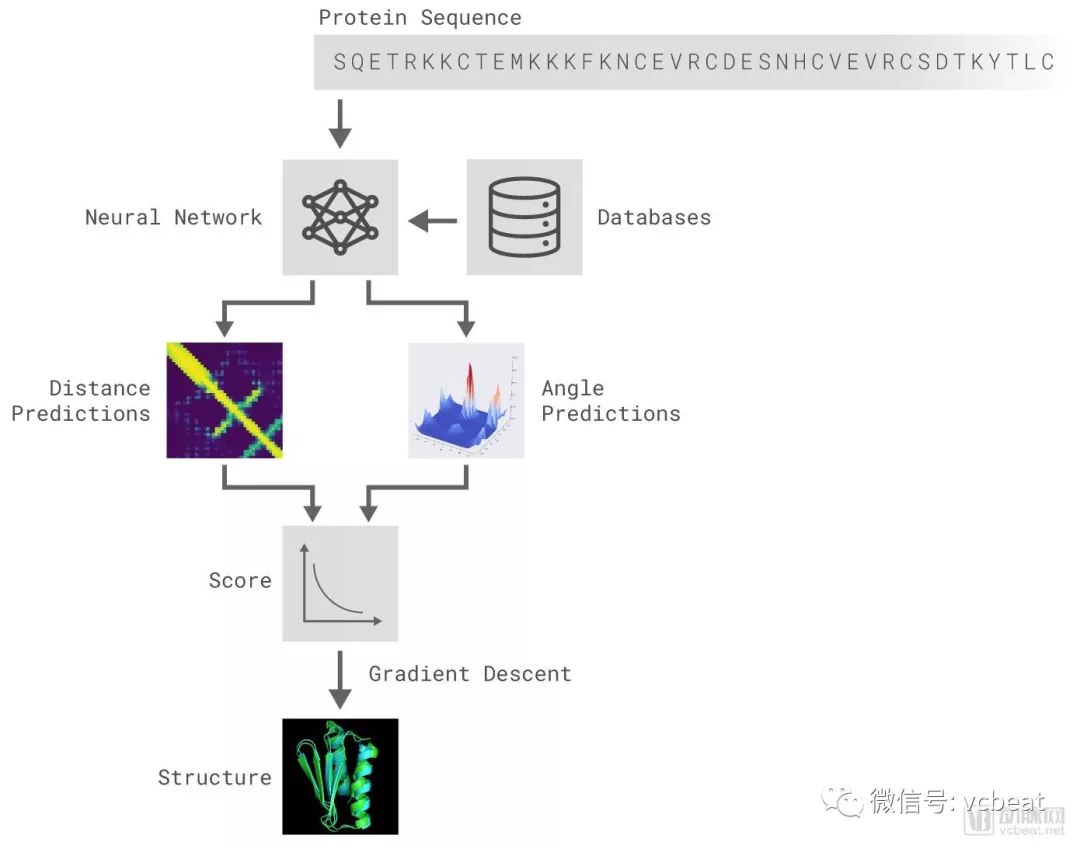
鑒于要研究的新蛋白質,AlphaFold使用神經網絡預測氨基酸對之間的距離,以及連接它們的化學鍵之間的角度。在第二步中,AlphaFold調整草圖結構以找到最節能的布置。
DeepMind訓練了一個神經網絡來預測蛋白質中每對殘基之間的距離的單獨分布。然后將這些概率組合成評估所提出的蛋白質結構的準確度的分數。此外,還訓練了一個單獨的神經網絡,該網絡使用匯總的所有距離來估計建議的結構與正確答案的接近程度。
使用神經網絡預測物理特性(圖片來源:DeepMind官網)
第二種方法通過梯度下降優化得分- 通常用于機器學習的數學技術,用于進行小的、漸進的改進這導致高度精確的結構。該技術應用于整個蛋白質鏈而不是在組裝之前必須單獨折疊的碎片,降低了預測過程的復雜性。
構建蛋白質結構預測的新方法(圖片來源:DeepMind官網)
使用這些評分函數,DeepMind能夠搜索蛋白質圖像,找到與我們的預測相匹配的結構。第一種方法建立在結構生物學中常用的技術上,并且用新的蛋白質片段反復替換蛋白質結構的片段。
為了構建AlphaFold,DeepMind在數千種已知蛋白質上訓練了一個神經網絡,直到它可以預測單獨使用氨基酸的3D結構。
一旦AlphaFold被提供了一種新蛋白質,它就會利用其神經網絡來預測其組成氨基酸對之間的距離,以及它們連接化學鍵之間的角度,形成一個牽伸結構。然后,AlphaFold調整此結構以找到最節能的結構。
雖然AlphaFold花了兩周的時間來預測第一個蛋白質結構,但該程序現在可以在幾個小時內完成。
AI將漫長費力的預測過程縮短至幾小時
根據英國《衛報》報道中的數據顯示,截至2010年,只有0.6%的已知蛋白序列被解析出了相應的結構。
在過去的五十年中,科學家們已經能夠使用冷凍電子顯微鏡,核磁共振或X射線晶體學等實驗技術來確定實驗室中蛋白質的形狀,但每種方法都依賴于大量的試驗和錯誤,這可能需要每年高達數萬美元的成本。這就是為什么生物學家正在轉向人工智能方法,以此作為這一漫長而費力的過程的替代方案。
對于蛋白質折疊的復雜性,曾有外媒載文稱,用當今最快的計算機模擬計算蛋白質折疊,要花100年。不過是在當時最快的計算機每秒幾萬億甚至十幾萬億次浮點運算的速度下,雖然目前性能最強悍的超級計算機每秒運算速度峰值可達20億億次,對于蛋白質折疊的模擬計算仍有可能耗費科學家數年乃至數十年的時間。
每個蛋白質都是一個氨基酸鏈,而后者的類型就有 20 種。蛋白質可以在氨基酸之間扭曲、折疊,因此一種含有數百個氨基酸的蛋白質有可能呈現出數量驚人(10 的 300 次方)的結構類型。通常,已經發現功能失常的蛋白質會導致疾病,并且歷史上,用藥物瞄準其結構、激活或停用它們會產生治愈效果。由于計算機的算法和算力局限,直到現在,了解蛋白質的結構并不容易。
根據中國科學院生物物理研究所生物大分子國家重點實驗室研究員,中國科學院院士王志珍的觀點,蛋白質的折疊和構象發生錯誤將會造成一些疾病,如阿爾茨海默氏癥,帕金森氏癥,亨廷頓氏癥和囊性纖維化等。隨著蛋白質折疊研究的深入,人們會發現更多疾病的真正病因和更加針對性的治療方法,從而設計更有效的要素。
如果科學家能夠學會從化學成分中預測蛋白質的形狀,他們可以弄清楚它的作用,它可能會誤導和造成傷害,并設計新的抗擊疾病或履行其他職責。簡而言之,了解蛋白質如何折疊,研究人員可以開創科學和醫學進步的新時代。
以老年癡呆癥(學名為阿爾茨海默氏癥)為例,它在人體的潛伏期長達十幾年之久,且病因復雜,以目前的醫學技術,臨床上甚至很難在發病前幾年檢測出這一疾病。
幸運的是,由于基因測序成本的快速降低,基因組學領域的數據非常豐富。因此,在過去幾年中,依賴于基因組數據的預測問題的深度學習方法變得越來越流行。DeepMind關于這個問題的工作產生了AlphaFold,并于今年提交給了CASP。
DeepMind在博客中稱:“我們很自豪能成為CASP組織者稱之為‘計算方法預測蛋白質結構能力的前所未有的進步’的一部分,在進入的團隊中排名第一。我們的團隊專注于從頭開始建模目標形狀的難題,而不使用先前解析的蛋白質作為模板。我們在預測蛋白質結構的物理性質時達到了高度的準確性,然后使用兩種不同的方法來構建完整蛋白質結構的預測。”
在2013年的某科技課題年度報告中我們發現這樣的描述:“虛擬藥物篩選及計算生物學受計算機資源及計算方法與軟件的限制,難以對數千萬個化合物進行比較系統的虛擬篩選,也難以實現一般蛋白質結構的從頭折疊模擬,無法滿足創新藥物和計算生物學研究的需求。因此,迫切需要開發超大規模并行的虛擬篩選,蛋白質折疊分子動力學模擬平臺,來滿足生命科學及創新藥物研究的需求。”
從這個方向來看,DeepMind的蛋白質結構預測的應用場景之一將是用于藥物創新的化合物篩選。
實際上,早在2016年AlphaGo計劃擊敗李世石之后,DeepMind就迅速將目光投向了蛋白質折疊。2017年10月,DeepMind在一次公開采訪中表示,團隊開始對人工智能在藥物開發中的應用感興趣,而新藥開發的關鍵一步,就是對靶點蛋白質三維結構的精準測算。
雷丁大學研究員Liam McGuffin表示:“預測任何蛋白質折疊形狀的能力是一個大問題。它對解決許多21世紀的問題具有重大意義,影響健康、生態、環境,并基本上解決任何涉及生命系統的問題。”
屢屢突破技術創新,DeepMind在醫療領域的探索
在AlphaGo一戰成名后,DeepMind曾經嘗試過許多用于數據驅動的工具和技術,特別是支持人工智能的機器學習方法,為改善醫療保健系統和服務提供了希望。Alphabet的執行主席 Eric Schmidt曾表示,以AlphaGo為代表的新的深度學習能力可以提高日常生產力,為企業帶來無數的機會,特別是在醫療保健、交通運輸和政府領域。
眼底篩查
2016年3月,DeepMind Health(現已納入Google Health)使用與AlphaGo系統相同的深度學習技術。已經與倫敦大學學院和Moorfields眼科醫院的研究人員使用深度學習技術創建軟件,通過3D掃描識別數十種常見眼病,然后建議患者進行治療。
這項工作是三個機構之間多年合作的結果。雖然該軟件尚未準備好用于臨床,但它可以在幾年內部署在醫院中。
根據發表在《Nature Science》上的論文中描述,該軟件在基于深度學習的既定原則,該原理使用算法來識別數據中的常見模式。在這種情況下,數據是使用稱為光學相干斷層掃描或OCT的技術對患者眼睛進行3D掃描,創建這些掃描大約需要10分鐘,并且需要從眼睛內部表面反射近紅外光,這樣做可以創建組織的3D圖像,這是評估眼睛健康的常用方法。
該軟件接受了來自約7,500名患者的近15,000次OCT掃描的培訓。這些人都在Moorfields眼科醫院接受治療。在一項測試中,AI的判斷與八位醫生組成的診斷進行了比較,該軟件在94%的時間內提出了同樣的建議。
乳腺癌篩查
2018年4月,Deepmind 加入了倫敦帝國理工學院英國帝國癌癥研究中心領導的一項開創性的新研究合作伙伴關系,探討人工智能技術是否可以幫助臨床醫生更快更有效地診斷乳腺癌乳腺癌。
研究將分析2007年至2018年期間在醫院采集的大約30,000名婦女乳房X線照片。這些將通過AI技術與已經提供的歷史去除乳房X線照片一起進行分析。通過英國OPTIMAM乳腺X線攝影數據庫,研究該技術是否能夠比現有的篩查技術更有效地發現這些X射線上癌組織的跡象。在項目過程中,Jikei大學醫院也將分享來自大約30,000名女性的乳房超聲檢查和3,500次乳房MRI檢查。
這些合作為通過提供DeepMind可用于培訓醫療保健工作算法的數據在NHS中更多地使用AI奠定了基礎。
協助醫生制定放療計劃
2018年9月,Deepmind 倫敦大學醫院NHS基金會信托基金放射治療部門正在開發一種人工智能(AI)系統,該系統能夠分析頭頸癌的醫學掃描圖像并作為專家臨床醫生以類似的標準將其分類。在計劃放射治療時,器官分割過程是一個必不可少但耗時的步驟。Deepmind正在開發一種新的性能指標,用于評估認為更能代表臨床過程的模型性能,以及一個測試集,幫助醫生進行器官分割與危及器官勾畫。
預測急性腎損傷惡化風險
2018年2月,Deepmind與美國退伍軍人事務部(VA)建立醫學研究合作伙伴關系,該部門是世界領先的醫療保健組織之一,負責為美國各地的退伍軍人及其家人提供高質量的醫療服務。
該項目正在與世界知名的VA臨床醫生和研究人員一起,分析來自大約700,000個歷史脫敏醫療記錄,以確定機器學習是否能夠準確地識別患者惡化的風險因素并正確預測其發病,主要專注于急性腎損傷(AKI)。
從DeepMind的上述研究可以發現,其在人工智能技術在諸多領域的探索仍處于試驗階段,并未進入臨床階段。
有媒體觀點認為,實際上,AI在生物學的整合并非個例。近年來以google為首的人工智能團隊在生物醫藥領域全面開花,已經在癌癥病理圖片識別,基因組突變檢測,疾病風險評估等諸多領域取得了等于與人類水平,甚至超過人類水平的耀眼成績。但這些表面看上去很成功的模型也都不可避免地受到普適性、可用性、可解釋性的障礙。
從算法上來看,DeepMind對于蛋白質折疊基礎研究的技術突破具有劃時代的意義。盡管Hassabis表示,DeepMind并沒有完全解決蛋白質折疊問題,預測只是第一步。“蛋白質折疊是一個極具挑戰的問題,但我們有一個很好的系統,以及一些尚未實施的想法。”
一個事實是,雖然AlphaFold的成就確實值得稱贊,但只有在研究論文中詳細介紹并進行同行評審時,才能理解該方法的獨創性,并成為一項研究成果。
話雖如此,AlphaFold在該事件中的全面成功是一個明顯的跡象,科學界可能很快就能夠借助技術有效地預測蛋白質的結構。
隨著其視野從游戲轉向現實世界的問題,看看DeepMind下一步把目光投向哪些科學問題也將是有趣的。





評論